inno.N 생산시설
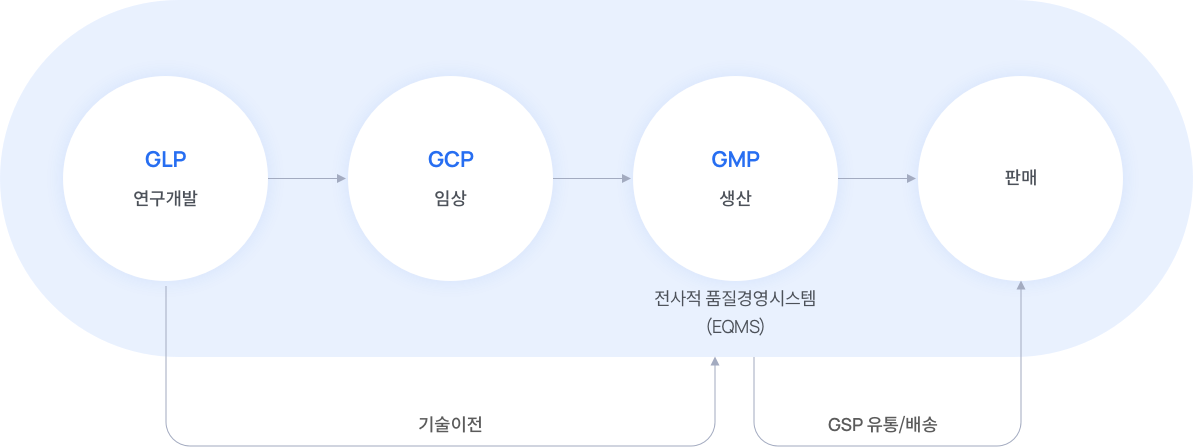
글로벌 수준의 IT System 운영과 데이터 완전성을 최우선 원칙으로 cGMP/EU GMP 기준에 적합한 품질시스템을 운영하고 있습니다.
Enterprise Quality Management System
-
품질 관리
제품품질 향상을 위한 정책 수립 및 품질관리시스템을 운영합니다. -
품질 보증
cGMP 기준의 품질이 확보된
의약품을 생산합니다. -
품질 개선
기술 지원을 통해 좋은 제품을 넘어 더 완벽한 품질을 완성합니다. -
품질 감사
지속적인 품질감사로 최고의 품질 경영 시스템을 유지 관리합니다.
품질 시스템 소개
품질 정책
OUR MISSION
Heal the World for a Better Life
고객의 더 나은 삶을 위해 건강한 세상을 만든다행동규범
- 우리는 항상 고객의 소리에 귀를 기울이고 작은 요구사항도 최선을 다해 대응하여
질병으로 고통받는 환자와 그 가족들을 위해 사회적 책임을 다합니다. - 우리는 보다 나은 품질을 위해 New Frontier 정신으로 끊임없이 개선합니다.
- 우리는 품질을 위해 원칙과 기준을 지키며 정직하게 행동합니다.
- 우리는 품질향상을 위한 적절한 구성원과 시스템을 갖추기 위해 노력합니다.

데이터 완전성
HK inno.N은 의약품 제조와 관련된 데이터의 품질과 데이터에 대한 완전성 보증을 위한 거버넌스를 구축하여 데이터 완전성을 최우선으로 하는 품질문화 확산을 적극 추진합니다.
첫째 경영진의 품질에 대한 철학이 반영된 정책과 윤리강령을 선언하고 적절한 자원 할당과 함께 체계적인 교육과 시스템을 구축하여 데이터 완전성 이슈 예방에 앞장섭니다.
둘째 개방적 조직문화 형성을 위해 개인이나 시스템의 데이터 완전성 실패나 실수, 또는 잠재적인 데이터 완전성 이슈에 대해 개방적인 소통과 보고의 활성화를 추진합니다.
셋째 데이터 완전성의 중요성 및 품질에 미치는 영향 등 데이터 완전성에 대한 구성원 인식 제고를 위해 체계적 교육 및 훈련을 수행합니다.
넷째 데이터의 위험평가 및 관리, 데이터 검토와 주기적 감시 등 데이터 완전성을 체계적으로 관리할 수 있는 절차와 시스템을 마련하여 운영하고 있습니다.
특히, HK inno.N은 최신 글로벌 GMP 규정에 따라 의약품 제조 및 품질관리와 연관된 모든 활동을 기록 관리하여 의약품의 제조 및 품질관리 데이터의 신뢰성을 강화하고 있습니다.
내부적으로는 품질 우선 마인드셋의 내재화를 위해 임직원을 대상으로 DI Letter를 배포하고, 데이터 완전성 교육 및 평가를 주기적으로 실시하며 데이터 완전성 인식 강화를 위한 다양한 활동을 지속적으로 추진하고 있습니다.
- 제조실행시스템(MES, Manufacturing Execution System)
- 실험실정보관리시스템(LIMS, Laboratory Information Management System)
- 품질운영시스템(QMS, Quality Management System)
- 전자문서관리시스템(EDMS, Electronic Document Management System)
| 종류 | 구분 | 주기 | 2023년 | 2022년 | 2021년 |
|---|---|---|---|---|---|
| 교육 | Dl Letter 발행 | 매월 | 10회 * | 12회 | 12회 |
| 데이터완전성 교육 이수 | 연 2회 | 2회 생산 본부 전 직원 (631명) |
2회 생산 본부 전 직원 (587명) |
2회 생산 본부 전 직원 (546명) |
|
| 회의체 | DI 위원회 운영 | 분기 | 4회 | 5회 | 3회 |
| DI 실무위원회 운영 | 분기 | 4회 | 5회 | 3회 | |
| 실사 | 데이터완전성 자체실사 | 연 3회 | 3회 | 3회 | 3회 |
* 23년부터 발행 주기 2~11월로 변경
글로벌 기준에 적합한 대한민국 최고의 의약품 생산 시설로
고품질의 내용고형제와 항암주사제, 수액제를 생산하고 있습니다.

-
01
cGMP / EU GMP
준수 -
02
최첨단 생산설비 및
생산 全 공정 IT System 운영 -
03
30년 이상 축적되어온
생산기술 및 실무경험 -
04
글로벌 수준의
안전환경 기준 충족
| 주소 | 충청북도 청주시 흥덕구 오송읍 오송생명2로 239 |
|---|---|
| 부지면적 | 146,013 m² |
| 건축면적 | 58,896 m² |
| 주요시설 | 내용고형제동, 항암주사제동, 수액동 등 12개동 |
| 주요생산제형 | 내용고형제, 항암주사제, 수액제 |
| 인증 현황 | KOSHA-MS, ISO 45001, ISO 14001, KGMP |
내용고형제동


항암제동
Closed system 운영을 통해 외부 오염을 완전 차단합니다.


국내 최대 규모, 최신 자동 설비를 갖춘 Smart Factory로
우수한 품질의 수액제를 생산하고 있습니다.

-
01
국내 최대 규모,
최신의 자동 설비 -
02
Big Data 분석 기반 사전
예측 운영의 Smart Factory -
03
태양광 에너지원 활용 등
친환경 제조소 -
04
글로벌 품질 System 운영 및
최고의 제품 품질 확보
| 주소 | 충청북도 청주시 흥덕구 오송읍 오송생명2로 239 |
|---|---|
| 부지면적 | 146,013 m² |
| 건축면적 | 32,191m² |
| 주요시설 | 수액동 내 생산라인, 자동화 창고, 유틸리티 시설 |
| 주요생산제형 | 수액제 |
| 인증 현황 | KOSHA-MS, ISO 45001, ISO 14001, KGMP |
수액동






수액제, 세파계 완제/원료의약품, 일반 원료의약품을
생산하여 국내 및 해외로 공급합니다.

-
01
일본 대형 제약사와
20여 년간 CMO 진행 -
02
수액 전문기술 확보 및
최신 GMP 수준의 자동화 설비 -
03
케이캡정 API (테고프라잔) 전용
생산시설 확보 -
04
20년 이상 축적해온
무균 항생제 제조 경험
| 주소 | 충북 음성군 대소면 대소산단로20 |
|---|---|
| 부지면적 | 58,278m² |
| 건축면적 | 28,411m² |
| 주요시설 | 수액제동, 테고프라잔동, 세파무균동, TPN동 등 25개 동 |
| 주요생산제형 | 수액제, 내용고형제, 세파계 원료의약품, 일반 원료의약품 |
| 인증 현황 | KOSHA-MS, ISO45001, KGMP, PMDA, Iran FDA |
테고프라잔 생산동


수액제동
Conveyer system에 의한 생산 방식으로 운영합니다.


세파 완제동


세파 원료동


30년 이상의 바이오 의약품 생산 기술력을 보유하여
생물학적제제 등을 국내 및 해외에 공급하고 있습니다.

-
01
GMP 규정에 적합한
백신 원액 생산시설 -
02
태국 등
20여 개국 해외등록제품 보유 -
03
고품질 제품 생산을 위한
품질관리 시스템 -
04
30년 이상 축적되어 온
생산기술 및 실무 경험
| 주소 | 경기도 이천시 마장면 덕평로 811 |
|---|---|
| 부지면적 | 34,751 m² |
| 건축면적 | 14,492 m² |
| 주요시설 | 백신원액 생산동, 에포카인 원액 생산동, 품질동 등 10개 동 |
| 주요생산제형 | 생물학적제제등 (백신, 유전자재조합), 항생주사제, 심혈관주사제 |
| 인증 현황 | KOSHA-MS, KGMP(의약품, 의료기기), TFDA, NADFC, Philippines FDA |
주사제 생산동


에포카인 원액 생산동

백신 원액 생산동


신뢰할 수 있는 GMP Cell Center 구축으로
첨단바이오의약품 개발과 우수한 품질의 제품 생산을 선도합니다.

-
01
국내 최대 규모 Closed system
자동화 생산 기기 보유 -
02
GMP 규정에 적합한 CGT (cell & gene therapy) 생산시설
-
03
고품질 제품 생산을 위한
품질관리 시스템 -
04
CGT 공정개발 및 최적화를 위한
인프라 확보
| 주소 | 경기도 하남시 하남대로 947 D동 |
|---|---|
| 연면적 | 약 1,508m² |
| 주요시설 | 공정개발실, 품질시험 분석실, 무균제조소, 보관소 등 |
| 주요생산제형 | 첨단바이오의약품(세포∙유전자 치료제) |
| 업허가 사항 | 첨단바이오의약품 제조업 허가(2022.08), 인체세포등 관리업 허가(2023.09), 세포처리시설 신고(2024.12) |
공정개발실


품질시험 분석실


무균제조소

